近日,来自德国慕尼黑亥姆霍兹研究中心的阿里·埃尔图尔克(Ali Ertürk)教授和荣周易博士以及中山大学孙逸仙纪念医院麦鸿成博士等人,完成了一项新冠后遗症的研究成果,揭示了病毒蛋白与脑部长期损伤之间的潜在联系。

图 | 麦鸿成博士 (左) 和荣周易博士(右)(来源:资料图)
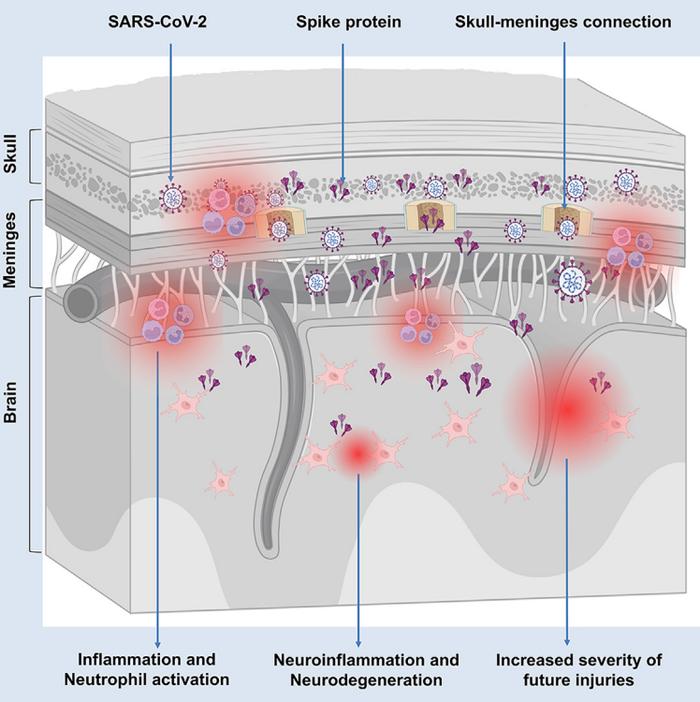
这项研究以“颅骨-脑膜-脑轴”为核心,首次揭示了新冠病毒刺突蛋白在颅骨内长期存在的可能性,并表明这可能会对神经系统造成深远影响。
总的来说,这项研究不仅揭示了刺突蛋白可能在长新冠中扮演的重要角色,还强调了“颅骨-脑膜-脑轴”这一解剖结构的重要性。
由于颅骨和脑膜比大脑实质更容易接触,因此这一发现能为诊断和治疗长新冠相关的神经症状提供新的可能。
例如,通过检测血液或脑脊液中与刺突蛋白相关的生物标志物,医生或许能够更早发现和预测长新冠的神经系统后遗症。同时,基于本次成果还可以针对刺突蛋白或其引发的炎症反应开发治疗方法。
此外,这项研究的成功离不开该团队研发的基于组织光透明的三维成像技术。
该技术能将患者和小鼠的样本进行透明化,从而让研究人员能以前所未有的方式观察组织内部的刺突蛋白分布。这一创新技术突破了传统显微镜的限制,为揭示复杂疾病机制提供了强大工具。
(来源:Cell Host & Microbe)
在应用前景上:
首先,可以基于本次成果开发诊断工具。即通过检测刺突蛋白或相关标志物,开发血液或脑脊液的非侵入性检测方法,以用于长期神经症状风险的筛查。
其次,可以基于本次成果开发治疗策略。即探索清除刺突蛋白或抑制其作用的药物疗法,比如抗体或小分子药物,这可能不仅会对治疗长期新冠产生效果,也将对其他病毒引发的神经炎症有帮助。
再次,可以基于本次成果进行疫苗优化。即研发能更有效减少病毒蛋白积累的疫苗,从而降低长期症状风险。
最后,可以基于本次成果开展疾病研究。刺突蛋白引发的炎症和蛋白质异常,在阿尔茨海默病等疾病中也有类似现象,因此本次成果能为研究病毒和神经退行性疾病间的关系提供了新思路。
(来源:Cell Host & Microbe)

长新冠之“谜题”
自新冠疫情暴发以来,许多患者即便在感染康复后仍会经历长期的神经系统问题,如脑雾、注意力难以集中、情绪波动甚至记忆力衰退。这些症状被统称为“长新冠”(Long COVID),但其具体成因却一直笼罩在迷雾之中。
那么,为什么新冠患者康复之后依然会有“脑部后遗症”?这是因为在感染新冠病毒之后,有些患者即便痊愈,但是仍会感到脑力迟钝和疲惫无力。
这不仅会影响患者的生活质量,也让科研人员感到困惑。虽然之前已有研究显示,病毒的组成成分可能会对大脑产生直接影响或间接影响,但是仍然没有明确的机制来解释这些长期症状的根源。
事实上,新冠病毒不仅会影响呼吸系统,还会对神经系统造成复杂影响。很多患者即便康复之后,依然存在疲劳、精神不集中、思维不清晰、记忆力减退等长期症状,但是人们并不清楚其背后的生物学机制。
更有意思的是,在有些患者的脑内即便并没有直接检测到病毒的存在,但是患者却依然存在严重的神经症状。
这种“谜题”让研究人员意识到,或许神经损伤并非完全依赖于病毒的直接感染,病毒残留的刺突蛋白本身就可能通过免疫炎症等间接方式影响大脑。
所以,这项研究所希望回答的问题是:
为什么会有长期神经症状?新冠与神经退行性变化之间的潜在联系是什么?
颅骨是否参与促进了新冠的神经症状?颅骨骨髓中病毒感染的证据和特征是什么?
疫苗是否有保护作用?在神经系统损伤的预防上,疫苗是否也能发挥作用?
(来源:Cell Host & Microbe)

或能催生长新冠专治药物
而本次研究首次发现:SARS-CoV-2 病毒的刺突蛋白可能是产生上述原因的关键所在。刺突蛋白是新冠病毒入侵人体细胞的“工具”,它在和人体细胞表面的 ACE2 受体结合之后能够进入细胞。
但是,在感染结束之后,这些刺突蛋白并未完全被人体清除,而是存在残留在特定区域尤其是残留在脑边界位置的可能。
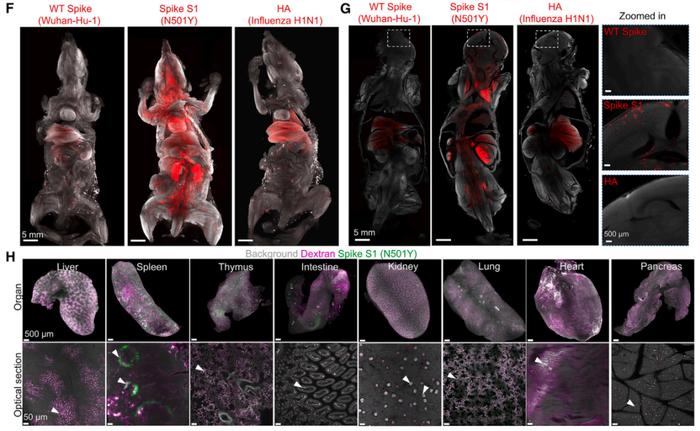
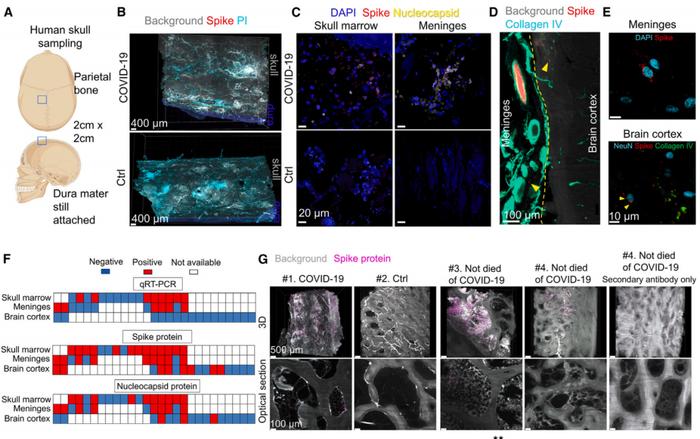
而刺突蛋白的“藏身之地”主要有两个地方:颅骨与脑膜。本次研究中,研究人员针对新冠患者的捐献标本进行组织光透明的三维成像分析,并将患者的颅骨和脑膜组织进行“透明化”,然后使用 Miltenyi Blaze 光片荧光显微镜进行观察。
结果发现:刺突蛋白广泛分布在颅骨骨髓、脑膜以及最近学界发现的一种解剖结构——“颅骨-脑膜连接”(SMCs,Skull-Meninges Connections)中。
这些连接结构是头骨与脑膜之间的通道,它们允许免疫细胞和分子在头骨与脑膜之间流动。刺突蛋白似乎能够通过这些通道进入脑膜,并能进一步地影响大脑组织。
此外,该团队还在一些康复患者的头骨和脑膜中发现了刺突蛋白,尽管这些患者并非死于新冠相关疾病,但是刺突蛋白依然存在于他们的身体之中。
同时,该课题组发现即使在患者的病毒 RNA 已经无法被检测到时,这些刺突蛋白仍然存在。这表明刺突蛋白的影响可能是一种独立于病毒复制的存在,即前者本身就可以引发炎症和神经损伤。
研究人员认为,这种残留的刺突蛋白可能引发了持续的免疫反应,进而导致神经炎症的发生。而这种现象或许可以解释为何有些患者即便在康复之后仍会出现长期的脑部症状。
该团队还发现,引发神经炎症和引发焦虑行为,也是刺突蛋白所能带来的两种作用。
为了进一步验证刺突蛋白的影响,他们将刺突蛋白直接注射到小鼠的颅骨骨髓中,结果发现这些刺突蛋白会迅速扩散到小鼠脑膜和小鼠大脑组织之中,并会引发显著的神经炎症反应。
在这些小鼠身上,他们还观察到了类似于焦虑的行为改变。例如,在开放环境之中,小鼠更倾向于回避中心区域,而这与人类长新冠患者中常见的焦虑症状和情绪症状高度吻合。
更加令人担忧的是,这些刺突蛋白还加剧了小鼠在脑梗死和创伤性脑损伤中的神经损害。这表明刺突蛋白可能不仅会直接引发神经炎症,还会让大脑在面对其他伤害时变得更加脆弱。
对于新冠疫苗大家也并不陌生。而本次研究发现疫苗并不能带来“绝对全能”的保护作用。该团队发现,接种疫苗的小鼠虽然能够显著减少刺突蛋白的积累,但仍无法完全消除其残留。
这意味着疫苗虽然对预防病毒感染和重症有重要作用,但对于长新冠中的某些症状,其保护作用可能有限。
研究人员表示:“这项研究的意义远超学术范畴。对于全球数百万长新冠患者而言,这项发现可能为他们提供新的希望。”
通过更深入地研究刺突蛋白的持久性及其对神经系统的影响,或许有望开发出针对长新冠的专门治疗药物,从根本上改善患者的生活质量。
总的来说,这项研究为人们揭开了新冠病毒对人类大脑影响的冰山一角,也让人们对长新冠这一复杂现象有了更深入的认识。
图 | 相关论文(来源:Cell Host & Microbe)
未来,他们将深入探讨刺突蛋白进入和滞留在脑组织的机制,以及探讨不同新冠病毒突变体之间的潜在差异。预计这些研究可能为新冠神经系统后遗症的准确诊断和个性化治疗铺平道路。
另外,对于去除或抑制刺突蛋白能否治疗新冠后遗症这一问题,他们也将开展后续探索。

参考资料:
1.Rong et al., Persistence of spike protein at the skull-meninges-brain axis may contribute to the neurological sequelae of COVID-19, Cell Host & Microbe (2024), https://doi.org/10.1016/j.chom.2024.11.007
运营/排版:何晨龙


