近日,美国圣路易斯华盛顿大学医学院团队开发了一种基于 T 细胞受体的自身免疫性 CD4+T 细胞疗法,可用于治疗脊髓损伤,并通过 mRNA 介导的短暂 T 细胞受体(TCR,T cell receptor)表达来最小化潜在的副作用。
这项研究为因交通事故、不慎坠落或运动事故引起的中枢神经系统(CNS,central nervous system)创伤性损伤带来新的希望。
实际上,这类事故已造成全球数百万患者运动与感知能力的丧失,为个人与社会造成极大的困扰和负担。但当下有效的治疗方法仍然难以实现。
在中枢神经系统遭到损伤后,损伤部位会被大量外周免疫细胞所浸润,包括 T 淋巴细胞。但迄今为止,对于这些内源性 T 细胞在损伤部位的作用及其抗原特异性的全面理解仍然缺乏。
之前的研究显示,针对自身抗原的 CD4+T 细胞在 CNS 损伤后能可能具有保护神经元的作用,但这些自身免疫性 T 细胞的长时间激活具有引发自身免疫疾病的风险。
该研究首次尝试利用 CD4+T 细胞疗法来治疗中枢神经系统损伤,并提供了一种基础的治疗模式,有望治疗其他中枢神经系统损伤和神经退行性疾病。
相关论文以《针对中枢神经损伤的工程化 T 细胞疗法》(Engineered T cell therapy for central nervous system injury)为题发在 Nature 上 [1]。

图丨相关论文(来源:Nature)
美国圣路易斯华盛顿大学医学院博士后高文青和博士后 Min Woo Kim 是共同第一作者,高文青和乔纳森·基普尼斯(Jonathan Kipnis)教授担任共同通讯作者。
研究伊始,该团队主要基于小鼠模型探讨机理,并针对治疗效果进行验证。
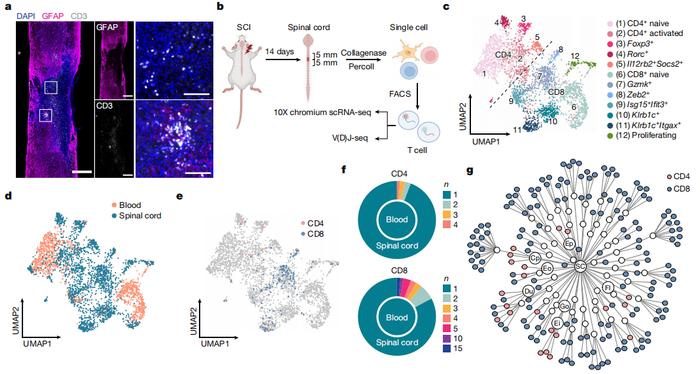
研究人员通过将损伤部位提取出的 T 细胞进行单细胞测序与 T 细胞受体(TCR)测序,发现了损伤部位 T 细胞的克隆性扩增,侧面证实了此类 T 细胞识别自身抗原的可能。
之后他们发现,在组织中浸润的 T 细胞能够识别神经系统内的髓鞘蛋白或源自其他神经元的蛋白质肽段。
接下来,研究团队采用视神经损伤模型作为筛选平台,对与脊髓损伤相关的 TCR 进行功能筛选。
他们发现,经过基因重组技术表达特定 TCR 的 CD4+T 细胞展现出了对中枢神经系统的保护效果。
为了消除损伤后期因自身免疫 T 细胞持续激活而引起的潜在自身免疫反应的问题,该课题组利用电穿孔技术将表达功能性 TCR 的 mRNA 转化入到 CD4+T 细胞内,使 CD4+T 细胞在短时间瞬时表达 T 细胞受体来实现对中枢神经系统的保护作用。
利用脊髓创伤的小鼠模型,研究人员证实经过工程 T 细胞治疗的小鼠比对照组个体表现出显著运动能力的增强。
组织病理学结果也证实在经过工程化 T 细胞治疗后,损伤部位的炎症水平受到明显控制。
此外,研究人员在利用 mRNA 重组表达 TCR 的基础上,通过 CRISPR-Cas9 技术将内源 TCR 基因敲除的方式,来避免内源 TCR 在疾病治疗时的干扰。
随后,然究人员希望进一步了解将 T 细胞疗法扩展至临床治疗的可行性。为此,该课题组将多位脊髓损伤患者脑脊液中的免疫细胞进行了单细胞测序分析。
测序结果表明脊髓损伤患者脑脊液中细胞类型与 T 细胞克隆性扩增的结果与小鼠损伤模型保持一致。
(来源:Nature)
据高文青介绍,其本科和博士分别毕业于中国农业大学和北京生命科学研究所。

图 | 高文青(来源:高文青)
在新冠疫情期间,她所在实验室曾经历过一次搬迁,基普尼斯教授因为工作更换,将课题组从美国弗吉尼亚大学搬到圣路易斯华盛顿大学。
搬迁后小鼠的养殖看护环境和实验设备都有了一些变化。高文青一度无法重复自己之前的实验结果,这曾让她非常纠结。
后来甚至连基普尼斯教授都想放弃,但是高文青还是决定再试一试,通过不断寻找问题根源,以及一步步地优化实验,最终完成了本课题的研究。
实际上,对于“保护性自身免疫细胞”的概念,就连高文青也在一开始持怀疑态度。因此,她最初只是抱着试试看的心态做实验。
大约半年之后,当她第一次看到神经保护作用的实验结果时,激动得立刻跑到导师办公室宣布好消息,这也让她第一次真正感受到研究带来的激励和动力。
在该研究中,主要讲述了免疫疗法对机械脊髓损伤保护的作用。
在中枢神经受损的过程中,无论是机械损伤还是神经退行性变化,尽管它们的原因各异,但最终都有可能以类似的机制导致神经元的损伤甚至死亡。
因此,在后续的研究中,该团队计划拓展本次的细胞治疗方案,并将探索在其他疾病模型中的治疗效果。
参考资料:
1.Gao, W., Kim, M.W., Dykstra, T. et al. Engineered T cell therapy for central nervous system injury. Nature (2024). https://doi.org/10.1038/s41586-024-07906-y
支持:曾华
运营/排版:何晨龙





举报成功